CRIMINALÍSTICA > Artículo académico
Determinación
DE PRESENCIA DE FLUIDO SEMINAL
en prendas lavadas
Instituto Universitario de Gendarmería Nacional Argentina (IUGNA), Argentina dalilavilte@gmail.com
RECIBIDO: 10 de septiembre de 2024
ACEPTADO: 10 de octubre de 2024

Resumen
En delitos contra la integridad sexual, el tiempo entre la comisión del delito y la intervención del especialista en criminalística suele ser extenso. Esto provoca injerencia de factores exógenos, que alteran los posibles elementos de análisis, como el lavado de la indumentaria vestida por la víctima. El objetivo de este estudio fue establecer presencia de fluido seminal en prendas estacionadas, a temperatura ambiente, por un período de treinta días y posteriormente lavadas en electrodoméstico automático con detersivo químico. Las pruebas de detección empleadas fueron: fuente de luz ultravioleta, inmunoensayo de antígeno prostático específico (PSA) y microscopía de espermatozoides. Para el análisis se emplearon muestras seminales procedente de seis donantes. Los resultados, empleando fuente de luz ultravioleta, fueron positivos con fluorescencia tenue, sólo en dos muestras de un mismo donante. En el análisis PSA, los resultados fueron positivos en la totalidad de las muestras examinadas, con intensidad débil. Por último, en la microscopía de espermatozoides, no se pudo detectar visualmente ninguna figura completa o seccionada en la totalidad de las muestras. Esta investigación indicó, que el examen PSA fue el método más adecuado para detectar fluido seminal en las condiciones establecidas.
Palabras clave
detección de fluido; semen; persistencia; PSA; luz UV; microscopia de espermatozoide
Determination of Seminal Fluid Presence in Washed Garments
Abstract
In cases involving sexual assault, the time elapsed between the commission of the crime and the intervention of the forensic expert is often prolonged. This delay allows for the interference of external factors, such as the washing of the victim’s garments, which can alter potential evidence. This study aimed to determine the presence of seminal fluid on garments stored at room temperature for thirty days and subsequently washed in an automatic washing machine using chemical detergent. The detection methods included: an ultraviolet (UV) light source, prostate- specific antigen (PSA) immunoassay, and sperm microscopy. Seminal samples from six donors were utilized for the analysis. The results, using the UV light source, showed faint fluorescence in only two samples from the same donor. In the PSA analysis, all samples tested positive, though with weak intensity. Lastly, sperm microscopy did not visually detect any intact or fragmented sperm cells in the samples. This investigation concluded that the PSA test was the most effective method for detecting seminal fluid under the specified conditions.
Keywords
luid detection; semen; persistence; PSA; UV light; sperm microscopy
1. Introducción
Uno de los indicios frecuentes de hallazgo en un asalto sexual suele ser el fluido seminal. Aunque este material biológico tiene gran importancia forense, por ser portador de perfil genético, puede estar presente de forma exigua, contaminado o depositado en diferentes soportes que pueden afectar el resultado de su análisis. A estos factores también se agrega el tiempo transcurrido hasta su recolección por los especialistas. En ocasiones, esto impide que los indicios biológicos se colecten y procesen con apremio (Brayley-Morris et al., 2015).
Ante estas circunstancias, surge el interrogante acerca de si es posible detectar fluido seminal, mediante pruebas convencionales de biología forense en muestras que sufrieron variables exógenas. Este cuestionamiento es relevante debido a que la integridad de las evidencias biológicas representa un requisito indispensable para ser presentada como objeto de prueba válida en el proceso investigativo.
En efecto, esta investigación presenta variables habituales que podrían alterar un indicio biológico. De esta manera, se planteó determinar la presencia de fluido seminal, en prendas íntimas, utilizando vedetinas y medias tipo soquetes con diferente composición textil. Los factores variables están dados por el tiempo de permanencia de la muestra depositada en la prenda y lavado automático con uso de detersivo químico.
Los datos emanados de este estudio permiten conocer la posibilidad de detectar fluido seminal mediante el uso de análisis convencionales e instrumentales primarios, como luz ultravioleta, inmunoensayo de Antígeno Prostático Específico y observación microscópica de espermatozoides. Estas pruebas aportan respuestas rápidas y contribuyen a la celeridad de los resultados.
2. Foco de estudio: Métodos de detección en muestras alteradas
Existe una gran variedad de estudios que abordan la determinación de presencia de fluido seminal en muestras que se ven afectadas por alguna variable exógena. En ellas, se analizan los factores externos y los métodos de detección convencional.
El abordaje académico impulsado por Karadayi et al. (2021) tuvo por objetivo conocer la detección de fluido seminal en prendas de diferente composición textil, almacenadas en tres períodos diferentes y sometidas a lavado automático. Los métodos empleados fueron: fuente de luz UV y ensayo Inmunocromatográfico de Antígeno Prostático Específico (PSA, por sus siglas en inglés). Los resultados fueron favorables en ciertos tipos textiles y en el menor tiempo establecido. La diversidad del estudio abarcó los soportes, no así en la muestra, ya que esta procedía de un único donante.
Un estudio efectuado por Karadayi et al. (2020) examinó prendas almacenadas durante un mes y luego sometidas al lavado automático utilizando detergente en polvo, quitamanchas y programado en dos temperaturas diferentes. Los métodos de detección utilizados fueron la fuente de luz forense, PSA y técnicas de electroforesis y espectrofotometría para recuperar perfil de ADN. Si bien este estudio brinda información de relevancia y especifica en cada técnica empleada, lo cierto es que, al igual que el estudio anterior, no ofrece diversidad en la muestra, debido a que utiliza un solo donante, tampoco establecen parámetros del tiempo de recolección. Otro de los factores bajo control de la experimentación fue el lavado individual por prenda, esta acción evita conocer la transferencia que puede influir para recuperar perfil genético. Más aun, en casos habituales donde la agresión sexual cuenta con múltiples perpetradores.
Por otra parte, Ogawa et al. (2017) han demostrado la identificación genética en un caso de agresión sexual a partir de prendas lavadas en seco, las conclusiones arribadas establecen que este tipo de limpieza no elimina las células espermáticas, ni epiteliales.
3. Importancia del fluido seminal en el ámbito forense
El fundamento de esta investigación se encuentra en las consideraciones del estudio generado por Alexander Gutman y Ethel Gutman (1941), quienes sustentaron que el plasma seminal es considerado un óptimo marcador forense. Por tres razones:
1) es estable a través del tiempo; 2) es especifico, porque se encuentra presente únicamente en el género masculino y 3) su detección puede hallarse en concentraciones mínimas.
3.1. SEMEN. DEFINICIÓN Y COMPOSICIÓN
De acuerdo a Mayoral-Andrade et al. (2006), el semen se define como una sustancia viscosa y blanquecina que comienza a producirse durante la pubertad masculina. El semen está constituido por una parte fluida donde se vehiculizan los elementos formes.
La parte fluida o plasma seminal, se origina en las secreciones de la próstata y glándulas del aparato genital masculino, que se juntan al momento de la eyaculación y son expulsados a través de la uretra (Hu et al., 2014).
De los elementos formes, el espermatozoide es el más relevante al diagnóstico pericial. En una eyaculación, la cantidad de espermatozoides oscila entre 30 a 150 millones por ml. Cantidades menores a los 30 millones por ml, caracterizan condición de oligozoospermia y su ausencia a la condición de azoospermia (López García, et al. 2012).
3.2. VALORACIÓN DE LAS TÉCNICAS DE DETECCIÓN DEL FLUIDO SEMINAL
Actualmente, existen múltiples métodos de detección de este tipo de fluido, los que son agrupados en dos categorías principales: técnicas convencionales y técnicas innovadoras. Las técnicas convencionales son de detección, y poseen carácter orientativo, presuntivo, de certeza o confirmación. Algunos de ellos son antígeno prostático específico, fosfatasa ácida prostática, luz de Wood, luz alternativa forense, microscopía, entre otros. Por otro lado, las técnicas innovadoras se centran en el uso de biomarcadores moleculares para la obtención de perfiles genéticos (Karadayi et al. 2021).
Como ya se expuso, la presencia de un espermatozoide es categórica para identificar semen. Sin embargo, la ausencia de estas células espermáticas no excluye el contacto sexual. Esto puede deberse a múltiples causas, como intervención quirúrgica de vasectomía, ausencia de eyaculación, condiciones de oligozoospermia y azoospermia, entre otras. Estas circunstancias hacen necesaria la incorporación del análisis pericial del plasma seminal (Suttipasit, 2015).
En este estudio se emplearon tres técnicas convencionales para la detección de semen: Fuente de Luz Ultravioleta, Antígeno Prostático Específico (PSA), Identificación de espermatozoides por microscopía óptica.
Fuente de Luz Ultravioleta
En la búsqueda de la sustancia biológica seminal, los forenses emplean esta fuente de luz que se basa en el principio de absorción y luminiscencia. Las manchas seminales tienen un amplio espectro de excitación, mayores a 300 nm. Este método representa una técnica de orientación. (Sheppard et al., 2017).
Antígeno Prostático Específico (PSA)
El PSA fue originalmente descripto por Sensabaugh (1978) bajo la denominación de p30, la cual adopta el comportamiento de una glucoproteína. Aunque esta sustancia también se encuentra en otras secreciones. El p30 configura un marcador útil del plasma seminal por funcionar como antisuero exclusivo del fluido contenido en el tejido prostático. En base a estos resultados, Sensabaugh logró afirmar que el PSA es un marcador específico del líquido seminal (Difrancesco y Sutton, 2015).
Identificación de espermatozoides por microscopía óptica
La identificación de los espermatozoides en este fluido biológico se efectúa observando la muestra obtenida en un microscopio óptico. La microscopía convencional es considerada como un método de confirmación, ya que la visualización de uno de los elementos formes es categórico, según Ogawa et al. (2017).
4. Materiales y metodología
La unidad de análisis fue obtenida a mediados de abril de 2021 en la localidad de Caleta Olivia, Provincia de Santa Cruz. Estas adoptan un carácter intencional, no representativo, procedente de seis donantes voluntarios de un rango etario de 26 a 36 años. Sin referentes de enfermedades crónicas y con una variante de intervención quirúrgica de vasectomía.
Se emplearon dieciocho soportes textiles nuevos, sin tratamiento previo al análisis, conformados por nueve vedetinas (30% de algodón y 70% de elastano) y nueve medias soquetes (80% de algodón, 15% de poliéster y 5% de goma).
Cada donante aportó un volumen promedio de 1.5 a 3 ml., que fue distribuido en tres prendas. Una de ellas destinada a muestra control y las dos restantes para experimentación. Para optimizar la identificación de la procedencia de las muestras en las prendas, se asignó a cada donante un tipo de prenda (vedetina/media soquete) y un color (gris, negro o blanco) (Tabla N° 1).
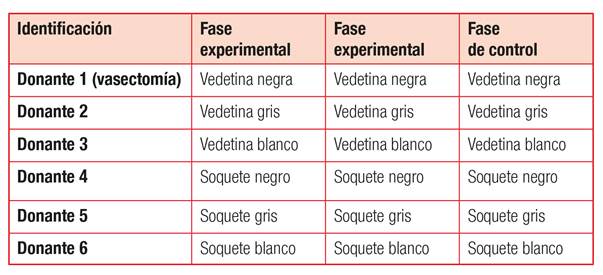
Tabla N° 1. Distribución de prendas por cada donante voluntario.
Fuente: Elaboración propia.
Se depositó muestra seminal en dieciocho prendas y almacenadas por un lapso de treinta días, en un armario de una habitación sin calefacción, manteniendo una temperatura oscilante entre 7 a 17 °C, por la época y región patagónica.
Transcurrido el período estipulado, las prendas se lavaron en conjunto en un lavarropas automático, marca Samsung, modelo WW90M4WP y se usó jabón líquido, marca Skip, baja espuma, fórmula clásica., con un programa de lavado diario, con velocidad de centrifugado de 1400 rpm, a una temperatura de 30° C, durante aproximadamente cincuenta y tres minutos. Finalizado el ciclo de lavado, las prendas se secaron en un ambiente interno a 27 °C. Posteriormente, se examinaron empleando las tres técnicas de detección mencionadas:
4.1. ANÁLISIS MACROSCÓPICO CON FUENTE DE LUZ ULTRAVIOLETA
Sobre una mesada se examinaron las muestras de control y las muestras de experimentación mediante fuente de luz ultravioleta, marca Crime-Lite, modelo 82S, configurada a una longitud de onda de 450 nm.
Muestra blanco: prenda antes de ser lavada y sembrada, la cual no presenta máculas de fluorescencia que consignar (Figura N° 1).

Figura N° 1. Muestra blanco, sin máculas fluorescentes. Fuente: Foto del autor.
Muestra de control: fluorescencia y fosforescencia intensa en la totalidad de las prendas, sobre sector de depósito de la muestra biológica (Figura N° 2).
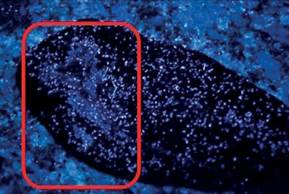
Figura N° 2. Mancha amorfa blanquecina: Donante 4. Fuente: Foto del autor.
Muestra testigo: en diez de las muestras de experimentación, no se observó luminiscencia alguna. Sin embargo, en las dos muestras procedentes del donante 4, se visualizó fluorescencia tenue (Figura N° 3).
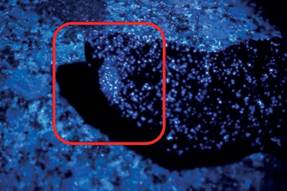
Figura N° 3. Mancha ovoide blanquecina: Donante 4. Fuente: Foto del autor.
4.2. ANÁLISIS CON REACTIVO DE ANTÍGENO PROSTÁTICO ESPECÍFICO (PSA)
Para la preparación de la muestra, se seccionó del sector teñido con líquido seminal un área de aproximadamente 1cm2. Posteriormente, estas porciones textiles fueron sumergidas en el interior de un tubo de ensayo con 2ml de solución fisiológica. Se dejó reposar por treinta minutos, tiempo en el que se realizaron movimientos circulares cada diez minutos. Luego, se retiró el fragmento de tela con una pinza. El sobrenadante resultante fue centrifugado en una centrífuga marca Gelec, modelo G142D, a una velocidad de 3500 rpm, durante siete minutos. Seguidamente, se extrajo con una pipeta 80 uL del sobrenadante, y se la dispuso en el interior de un tubo de ensayo estéril. En cada tubo se asignó una tira reactiva de PSA, dejándola actuar por tres minutos. Transcurrido este periodo, se dejó actuar durante otros cinco minutos fuera del recipiente. Este ensayo imnunocromatográfico actúa por acción de capilaridad, revelando resultados positivos a través de la visualización de dos líneas transversales y una única franja indica resultados negativos.
Muestra de control: las seis tiras reactivas, tuvieron reacción positiva con coloración “intensa” en comparación a las muestras de experimentación.
Muestras testigo: las doce tiras reactivas arrojaron reacciones positivas de e intensidad tenue, frente a las muestras de control. La coloración emitida por las tiras, no es indicativo de un resultado ambiguo (Figura N° 4).
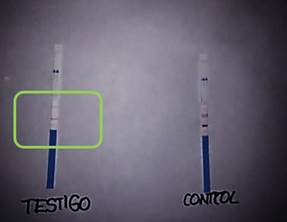
Figura N° 4. Tira reactiva inmunocromatografica: Donante 2. Marcado con verde resultado positivo con intensidad tenue. Fuente: Foto del autor.
4.3. ANÁLISIS DE ESPERMATOZOIDE POR MICROSCOPÍA ÓPTICA
En este examen, se tomó el sedimento de la muestra antes tratada y fue colocada en un porta-objetos, para ser observada microscópicamente a 40X, en un Microscopio Binocular con iluminación X-Led3 blanca, modelo B-292PLi, marca Optika. A fin de visualizar células espermáticas.
Muestra de control: en cinco muestras de control, se visualizaron espermatozoides. En tanto que, en la muestra de control que refiere al donante vasectomizado, no se observaron los elementos formes buscados (Figuras N° 5 y 6).
Muestras de experimentación: en la totalidad de estas muestras, no se visualizaron existencias de microorganismos formes (Figuras N° 7 y 8).
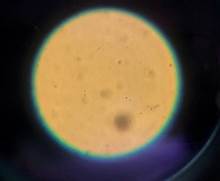
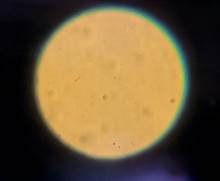
Nota: Muestra control. Nota: Muestra experimental.
Figuras N° 5 y 6. Microscopia de espermatozoides: Donante 1. Fuente: Foto del autor.
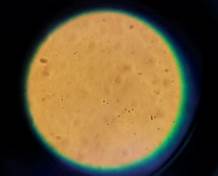
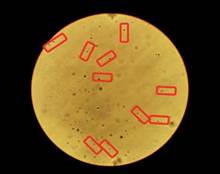
Nota: Muestra control. Nota: Muestra experimental.
Figuras N° 7 y 8. Microscopia de espermatozoides: Donante 3. Fuente: Foto del autor.
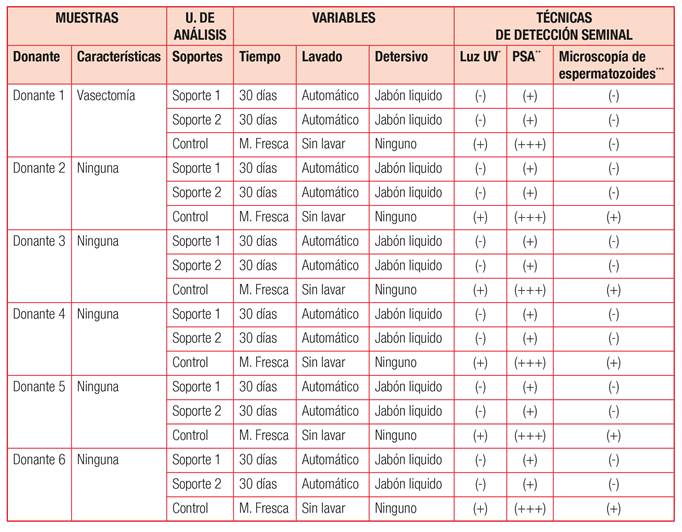
Tabla N° 2. Matriz de Datos
Referencias
*Luz Ultravioleta: Intenso (+++); Débil (+); Nulo (-).
**PSA: Positivo intenso (+++); Positivo débil (+), Negativo (-).
***Microscopia de espermatozoides: Existente (+); Inexistente (-).
5. Resultados
En el método orientativo empleando luz de Wood, las muestras de control reaccionaron en un rango entre los 350 y los 500nm, tal como lo establecieron Sheppard et al. (2017).
En contraposición, no se observó este resultado en la mayoría de las prendas de experimentación, exceptuando dos soquetes negros en donde la fluorescencia era tenue. Esta reacción, puede vincularse a la constitución textil de la prenda, en la que prevalece mayor porcentaje de algodón, lo que significa fibras con mayor capacidad de absorción (Suttipasit, 2015). Además, se debe tener en cuenta lo expresado por Vandenberg y Van Oorschot (2006), quienes reportaron en su investigación que las manchas seminales contenidas en soportes de tonalidades oscuras permiten una mejor visualización frente a las luces UV.
Durante el examen de detección de PSA los resultados positivos fueron alentadores y similares a los obtenidos por Jobin y De Gouffe (2003). Por lo tanto, se deduce que el empleo de detergente líquido no tuvo injerencia en los resultados obtenidos.
Por último, en el análisis microscópico de espermatozoide, en ninguna de las prendas de experimentación se visualizó la presencia de las células en cuestión. Estos resultados fueron inversos a los registrados en la experimentación de Nolan et al. (2018), donde después de lavados múltiples obtuvieron resultados positivos empleando microscopía. Aunque este equipo de investigación, no especifica el equipamiento utilizado, si se menciona que el ciclo de lavado era de quince minutos y utilizando agua fría (15-20°C). Datos que se contraponen en el tiempo y temperatura de esta experimentación, de cincuenta y tres minutos y a una temperatura de 30°C. Estas variables pudieron llegar a incidir en la conservación de las estructuras espermáticas en los textiles.
Finalmente, en las muestras con resultados positivos de PSA, no se hallaron espermatozoides completos y/o fragmentados. Esta situación impulsa a analizar las muestras ofrecidas para estudio con diferentes métodos de detección de fluido seminal. Esto debido a que la carencia de células espermáticas no determina ausencia de este fluido biológico, como es el caso en condiciones de oligospermia, azoopermia o de intervención quirúrgica de vasectomía (Suttipasit, 2019).
6. Conclusiones
En esta investigación, se utilizaron diversos marcadores para la detección seminal, integrando labores de visu, como la macroscópica con fuente de luz ultravioleta y labores en laboratorio mediante ensayo inmunocromatográfico de detección del antígeno prostático específico (PSA) y observación de espermatozoides con microscopía óptica.
![]() El empleo de métodos
de análisis convencionales de la biología
forense representa una fortaleza
en la investigación. Esto se debe a que los marcadores de uso cotidiano en un
laboratorio de este tipo permiten brindar una respuesta rápida y variada en
cuanto a la evaluación de los componentes de las muestras biológica procesadas.
El empleo de métodos
de análisis convencionales de la biología
forense representa una fortaleza
en la investigación. Esto se debe a que los marcadores de uso cotidiano en un
laboratorio de este tipo permiten brindar una respuesta rápida y variada en
cuanto a la evaluación de los componentes de las muestras biológica procesadas.
En el método orientativo de luz UV, se evaluó el espectro de excitación de los compuestos biológicos del semen frente a la incidencia de dicha luminaria. Un 16% de las muestras experimentales que reaccionaron de forma positiva con una intensidad tenue. Por otra parte, en el examen microscópico de células espermáticas, la experimentación degradó su estructura, lo que impidió su detección. Por último, y en el mejor de los casos en la evaluación del plasma seminal, mediante el uso del ensayo inmuno-cromatográfico de antígeno prostático específico (PSA), los datos revelados fueron favorables, con resultados positivos en el 100% de las muestras.
La información emitida por este estudio indica que, para detectar fluido seminal en los parámetros establecidos, se debería utilizar varias pruebas sobre una muestra, ya que la pluralidad de análisis aportó mayor información y permitió argumentar los datos obtenidos.
A raíz de ello, se puede sugerir en futuras líneas de investigación adicionar técnicas de biología molecular (ADN, ARN mensajero, micro ARN). Estos estudios brindan información certera, ya que determinan el perfil genético, y el material disponible puede ser empleado como medio de cotejo en casos de contar con muestras dubitables.
7. Bibliografía
Brayley-Morris, H.; Sorrell, A.; Revoir, A. P.; Meakin, G. E.; Court, D. S y Morgan, R. M. (2015). Persistence of DNA from laundered semen stains: Implications for child sex trafficking case. Forensic Science International, 19, 165-171.
Difrancesco, J. y Sutton, J. (2015). Re-evaluation of the Seratec® PSA Semiquant test: comparison of kit provided buffer with phosphate buffer saline. Canadian Society of Forensic Science Journal, 48, 137-151. https://doi.org/10.1080/00085030.2015.1051315
Gutman, A. B., Gutman, E. B. (1941). Quantitative Relations of a Prostatic Component (Acid Phosphatase) of Human Seminal Fluid. Endocrinology, 28, 115. https://doi.org/10.1210/endo-28-1-115
Hu, L.; Wu, C.; Guo, C.; Li, H. y Xiong, C. (2014). Identification of microRNAs predominately derived from testis and epididymis in human seminal plasma. Clinical Biochemistry, 47, 967-972. https://doi.org/10.1016/j.clinbiochem.2013.11.009
Jobin, R. M., y De Gouffe, M. (2003). The Persistence of Seminal Constituents on Panties After Laundering. Significance to Investigations of Sexual Assault. Canadian Society of Forensic Science Journal, 36, 1–10. https://doi.org/10.1080/00085030.2003.10757551
Karadayı, Ş.; Karadayı, B.; Öner, D.; Çetin, G. (2021). Evaluation of the relationship between the detectability of seminal stains on laundered fabric and stain age. Medicine, Science and the Law; 61(3), 198-207. https://doi.org/10.1177/0025802421992916
Karadayı, Ş.; Moshfeghi, E.; Arasoglu, T. y Karadayi, B. (2020). Evaluating the persistence of laundered semen stains on fabric using a forensic light source system, prostate-specific antigen Semiquant test and DNA recovery-profiling. Medicine, Science and the Law, 60(2):122-130. https://doi.org/10.1177/0025802419896935
Kulstein, G.; Schacker, U. y Wiegand, P. (2018). Old meets new: Comparative examination of conventional and innovative RNA-based methods for body fluid identification of laundered seminal fluid stains after modular extraction of DNA and RNA. Forensic Science International. Genetics, 36, 130-140. https://doi.org/10.1016/j.fsigen.2018.06.017
López García, M.; Urbano Felices, A. y Cardenas Povedano, M. (2012). Manual de laboratorio para análisis del semen. OmniaScience. doi: 10.3926/oss.5
Mayoral-Andrade, G.; Pérez-Campos, E.; Martínez-Martínez L. y Hernández-Cruz, P. (2006). Identificación forense de fluido seminal. Lab-acta, 17, 43-46.
Noël, S.; Lagacé, K.; Raymond, S.; Granger, D.; Loyer, M.; Bourgoin, S.; Jolicoeur, C. y Séguin, D. (2018). Repeatedly washed semen stains: optimal screening and sampling strategies for DNA analysis. Forensic Science International: Genetic, 38, 9-14. https://doi.org/10.1016/ j.fsigen.2018.10.002.
Nolan, A.; Speersa S., Murakamib J. y Chapman B. (2018) A pilot study: The effects of repeat washing and fabric type on the detection of seminal fluid and spermatozoa. Forensic Science Journal; 289, 51-56. https://doi.org/10.1016/j.clinbiochem.2013.11.009
Ogawa, H.; Hiroshige, Y.; Yoshimoto, T.; Ishii, A.; Yamamoto, T. (2017). STR Genotyping from a Dry-Cleaned Skirt in a Sexual Assault Case. Forensic Science International, 63, 342–352. https://doi.org/10.1111/1556-4029.13698.
Sensabaugh, G. F. (1978). Isolation and characterization of a semen-specific protein from human seminal plasma: a potential new marker for semen identification. Journal of forensic sciences, 23(1), 106–115.
Sheppard, K.; Cassella, J. P.; Fieldhouse, S. y King, R. (2017). The adaptation of a 360° camera utilising an alternate light source (ALS) for the detection of biological fluids at crime scenes. Science & justice : journal of the Forensic Science Society, 57(4), 239-249. https://doi.org/10.1016/ j.scijus.2017.04.004
Suttipasit, P. (2015). Comparison of Two Seminal Detection Methods, The Acid Phosphatase Test and The Zinc Test for Sensitivities in Sexually Assaulted Females Positive of Sperm. Siriraj Medical Journal, 67(4). https://he02.tci-thaijo.org/index.php/sirirajmedj/article/view/55230
Suttipasit P. (2019). Forensic Spermatozoa Detection. The American journal of forensic medicine and pathology, 40(4), 304–311. https://doi.org/10.1097/PAF.0000000000000517
Vandenberg, N. y Van Oorschot, R. A. (2006). The use of Polilight in the detection of seminal fluid, saliva, and bloodstains and comparison with conventional chemical-based screening tests. Journal of forensic sciences, 51(2), 361–370. https://doi.org/10.1111/j.1556-4029.2006.00065.x
Cita sugerida
Vilte, D. L. (2024). Determinación de la presencia de fluido seminal en prendas lavadas. Minerva. Saber, arte y técnica, 8(2). Instituto Universitario de la Policía Federal Argentina (IUPFA), pp. 34-45.
* Vilte, Dalila Lourdes
Licenciada en Criminalística. Oficial Principal de la Policía de Santa Cruz.